ASİT, TUZ ve BAZ
Asit ve bazlar canlı organizmalarda önemli işlevleri olan maddelerdir. Asitlerin ve bazların çoğu oldukça tehlikeli ve tahrip edici maddelerdir; bunlar proteini çözerek dokuyu tahrip ederler. Örneğin, derişik sülfürik asit kuvvetli bir asittir, suyu tutma özelliğine sahiptir. Eğer sülfürik asit canlı bir dokunun üzerine dökülürse çok kısa süre içinde o doku tahrip olur. Derişik bazlar da hücre duvarlarının (zar) yapımında rol alan yağlar ile reaksiyona girerek bu zarları asitlerden daha çok tahrip ederler. Örneğin, çamaşır yıkamada kullanılan bazı tür sabunlar ve deterjanlar baz içerirler. Yün ve ipek içeren elbiseler bu tür sabun ve deterjan ile yıkandıkları zaman, temizlik maddesinin içindeki bazlar yün ve ipek liflerinin kısalmasına ve kısmen de olsa çözülmelerine sebep olacaktır.
Asitler suda çözündükleri zaman elektriği ileten çözeltiler elde ederiz. Asitler çinko, magnezyum gibi elementler ile reaksiyona girerek reaksiyon sonunda hidrojen gazı çıkmasına neden olurlar. Asitlerin tadı ekşidir ve mavi turnusol kağıdını kırmızıya çevirirler. Bazlar da suda çözündükleri zaman elektriği ileten çözeltiler oluştururlar. Bazların tadları acıdır ve ellendikleri zaman kayganlık hissi verir. Bazlar kırmızı turnusol kağıdını maviye çevirirler. Bazlar asitler ile reaksiyona girerek birbirlerinin özelliklerini nötralize ederler.
Örneğin, mide hastalıkları ile ilgili ilaçlar bir baz olan bikarbonat (HCO3 ) içerirler. Bu baz midede bulunan hidroklorik asiti nötralize ederek kişiye rahatlama hissi verir.
Asitler ------------- Formülü ------------- Yer
Hidroklorik asit --- HCl ------------------ Mide özsuyu
Sitrik asit --------- C6H8O7 ----------- Limon suyu
Fosforik asit ------ H3PO4 ------------- Coca-Cola gibi içkiler
Asetik asit -------- CH3COOH--------- Sirke
Karbonik asit ----- H2CO3 ------------- Gazoz
Tartarik asit ----- C4H6O6 ----------- Şarap
Bazlar --------------- Formülü ----------------- Kullanım Yeri
Amonyak ------------ NH3 --------------------- Gübre yapımı
Sodyum hidroksit -- NaOH-------------------- Sabun yapımı
Sodyum bikorbonat- NaHCO3 ---------------- Cam yapımı, gübre yapımı
2. ASİT VE BAZLARIN TANIMLANMALARI
Günümüze kadar asitliğin ve bazlığın tanımı çok değişik şekillerde yapılmıştır. İlk modern
tanım İsveç'li bilim adamı Svonte ARHENİUS tarafından 1884 yılında aşağıdaki şekilde
yapılmıştır.
Sudaki çözeltilerine H+ iyonu veren maddelere "asit" denir.
Aynı şekilde, Sudaki çözeltilerine OH- iyonu veren maddelere "baz" denir.
Örneğin, hidroklorik asit (HCl) ve sodyum hidroksit (NaOH) için aşağıdaki eşitlikler yazılabilir.
İkinci bir tanımlama ise Danimarka'lı kimyacı J.N. BRØNSTED ve İngiliz kimyacı T.M.
LOWRY tarafından 1923 yılında yapılmıştır. Buna göre,
Bir proton verebilen maddelere "asit",
bir proton alabilen maddelere "baz" denir.
Bu tanımlamayla daha önceleri asit veya baz olarak düşünülmeyen birçok madde asit ve baz grubuna alınmıştır. Örneğin, bor triflorür bir asit gibi davranarak trimetilamin'deki azot üzerindeki bir çift elektronu kabul ederek bir kompleks oluşturur.
H2O
NaOH → OH- + Na+
H2O
HCl → H+ + Cl-
Asit Baz
ASİT VE BAZLARIN KUVVETİ
Suyun iyonlaşmasına ilişkin eşitliği, anlaşılması daha kolay olsun diye aşağıdaki şekilde yazarız:
Sulu çözeltilerden bahsettiğimiz zaman "proton" veya "hidrojen iyonu" terimini kullanırız.
Fakat, gerçekde hidrojen iyonları su içinde hiçbir zaman tek başlarına bulunamaz.
Bunlar her zaman hidronyum iyonu (H3O+ ) denilen bir yapı içinde bulunurlar.
Hidronyum iyonları bir molekül suya ait hidrojen iyonunun (H+ ) bir diğer su molekülüne aktarılması ile oluşan yapılardır.
Asitleri proton veren maddeler olarak tanımlamıştık. Ancak farklı asitlerin proton verme yatkınlıkları farklıdır. İşte bu farklılık kuvvetli asit, kuvvetli baz, zayıf asit ve zayıf baz kavramlarının ortaya çıkmasına neden olur.
Derişimleri aynı olan farklı asitlerin güçleri aynı değildir.
Çözeltilerde tamamen iyonlaşarak tüm protonlarını veren asitlere "kuvvetli asit" denir.
Çözeltilerde kısmen iyonlaşarak protonlarının bir kısmını veren asitlere de "zayıf asitler" denir.
Kuvvetli bir asit çözeltisini suya ilave ettiğimiz zaman hidronyum iyonlarının derişiminde büyük bir artış olur. Örneğin, nitrik asit (HNO3 ) kuvvetli bir asittir. 0,1 Molar HNO3 içinde nitrik asit moleküllerinin % 92 'si iyonlaşarak hidronyum ve nitrat iyonu oluştururlar.
H2O → H+ + OH- Su
Hidrojen Hidroksit iyonu iyonu (Baz) (Proton)
H2O + H2O → H3O+ + OH-
Hidronyum Hidroksit iyonu iyonu (Baz) (Asit)
Hidroklorik asit (HCl), hidrobromik asit (HBr), hidroiyodik asit ve sülfürik asit (H2SO4 ) diğer kuvvetli asitlere örnektir.
Bir zayıf asitin suya ilavesi hidronyum iyonlarının derişimini çok az artırır. Örneğin, zayıf
bir asit olan asetik asitin 0.1 molar çözeltisinde asetik asit moleküllerinin ancak % 1,3'ü iyonlarına ayrışarak hidronyum ve asetat iyonlarını oluşturur.
Nitroz asit (HNO2), karbonik asit (H2 CO3 ), borik asit (H3 BO3 ) zayıf asitlere örnektir.
HNO3 + H2O → H3 O + + NO3
- Nitrik asit Baz Asit Nitrat iyonu
CH3 COOH+ H2O → H3 O + + CH3 COO-
- Asetik asit Baz Asit Asetat iyonu
Konjuge asit
Adı ----- Formül
Florosülfonik asit -----FSO3 H
Sülfürik asit ----- H2 SO4
Hidroklorik asit ----- HCl
Nitrik asit ----- HNO3
Hidronyum iyonu ----- H3 O+
Sulfuroz asit ----- H2SO3
Hidrojen sülfat iyonu ----- HSO4 -
Fosforik asit ----- H3PO4
Nitroz asit ----- HNO2
Asetik asit ----- CH3 COOH
Karbonik asit ----- H2 CO3
Hidrojen sülfit iyonu ----- HSO3 -
Dihidrojen fosfat iyonu ----- H2PO4-
Amonyum iyonu ----- NH4 +
Hidrojen karbonat ----- HCO3 -
Hidrojen fosfat iyonu ----- HPO4-2
Su ----- H2O
Amonyak ----- NH3
Konjuge baz
Adı ----- Formül
Florosulfonat ----- FSO3-
Hidrojen Sülfat iyonu ----- HSO4-
Klorür iyonu ----- Cl -
Nitrat iyonu ----- NO3-
Su ----- H2 O
Hidrojen sülfit iyonu ----- HSO3-
Sülfat iyonu ----- SO4- 2
Dihidrojen fosfat iyonu ----- H2 PO4-
Nitrit iyonu ----- NO2-
Asetat iyonu ----- CH3COOBikarbonat
iyonu ----- HCO3-
Sülfit iyonu ----- SO3- 2
Hidrojen fosfat iyonu ----- HPO4- 2
Amonyak ----- NH3
Karbonat iyonu ----- CO3- 2
Fosfat iyonu ----- PO4- 3
Hidroksit ----- OH-
Amid iyonu ----- NH2-
Konjuge asit ve konjuge baz nedir?
Bir baz bir asitin protonunu kaybetmesiyle oluşuyor ise bu baza "konjuge baz" denir.
Örneğin tüm protik asitleri HA ile simgelersek
Asetat iyonu (CH3 COO- ) asetik asitin (CH3 COOH) konjuge bazıdır.
Aynı şekilde,
Bir asit bir bazın bir proton kazanmasıyla oluşuyor ise bu asite "konjuge asit" denir.
Örneğin,
Bir baz olan amonyak (NH3) bir proton kazanarak amonyum iyonu (NH4+) oluşturur.
Amonyum iyonu fazladan gelen protonu (H+ ) daha sonra vererek bir asit gibi davranır.
Kısaca, NH4+ iyonu NH3 'ün konjuge asitidir.
Asit H+ + Konjuge baz
HA → H+ + A -
Asit Konjuge baz
CH3 COOH → H+ + CH3 COO-
Asit Konjuge baz
H2O
Baz + H+ Konjuge asit
B + H+ BH+
Baz Konjuge asit
NH3 + H2O → NH4+ + OH-
Baz Konjuge asit
Kısaca, bir asit ile bir baz arasındaki fark bir protondan (H+) dolayı oluşuyor ise bunlara "konjuge asit-baz çifti" denir.
Bir asit ne denli zayıfsa, konjuge baz o denli kuvvetli olur.
Aksine bir baz ne denli kuvvetli ise, konjuge asiti o denli zayıf olur.
Benzer şekilde, kuvvetli bir baz proton kapmaya çok eğilimlidir. Zayıf bir baz ise protonları çok az bir yüzdesi ile kabul eder. Örneğin, hidroksit iyonu (OH- ) kuvvetli bir bazdır ve protonlar ile derhal reaksiyona girer. Halbuki amonyak (NH3 ) zayıf bir bazdır ve hidroksit iyonuna kıyasla protonlara karşı ilgisi daha azdır.
Çizelge 11.2 'i incelerken dikkat edeceğimiz en önemli konu, asitlerin formüllerindeki hidrojen sayısı ile bu asitlerin asitlik kuvvetleri arasında bir ilişkinin olmayışıdır.
Örneğin, hidroklorik asit (HCl) fosforik asite (H3PO4) kıyasla çok kuvvetli bir asittir.
tüm maddelerin bir asitlik ve bazlık kuvveti vardır.
Tüm maddeleri bir skala içine sokabiliriz.
Maddelerin asit veya baz olarak hareket etmeleri ve dolayısıyla asit veya baz olarak adlandırılmaları, birbirine göre göreceli olan asitlik veya bazlık kuvvetleri ile ilişkilidir.
Örneğin, su bileşiğini ele alalım, su, asitliği kendinden fazla bir madde olan hidroklorik asit (HCl) ile karşı karşıya geldiği zaman bir baz gibi davranır. Buna karşılık aynı su bileşiği asitliği kendinden daha düşük olan amonyak (NH3) ile karşı karşıya geldiği zaman bir asit gibi davranır.
H2O + HCl → H3O + + Cl -
Baz Asit Asit Baz
H2O + NH3 →NH4+ + OH-
Asit Baz Asit Baz
ASİTLERİN VE BAZLARIN DERİŞİMİNİN ÖLÇÜLMESİ
5.1. pH Skalası
Canlı organizmalar içindeki veya bir bilimsel araştırmada hidrojen iyonu (H+ ) derişimindeki çok ufak değişikler çok önemli sonuçlar ortaya çıkarabilir. Bundan dolayı, bilim adamları sürekli olarak hidrojen iyonu derişimi ile ilgilenmişler ve bunu ölçme teknikleri geliştirmişlerdir.
İsveç'li kimyacı Sorensen 1909 yılında hidrojen iyonu derişimini ölçmek için "pH skalası" denen bir yöntem geliştirilmiştir. Buna göre, hidrojen iyonu derişimi matematiksel olarak şöyle ifade edilmiştir.
[H+ ] = 1 x 10 -pH mol / lt veya
pH = -log [H+ ]
H+ + Cl - + Na + + OH- → H2O + Na + + Cl -
HCl + NaOH → H2O + NaCl
Asit Baz Su Tuz
H+ + OH- → H2O
Bir çözeltinin pH 'si bu çözeltinin hidrojen iyonu [H+ ] derişiminin eksi (-) logaritmasına eşittir.
pH Skalasını logaritmik olarak ifade etmemizin sebebi, çok küçük rakamlar ile ifade edilen [H+] iyonu derişimini tam sayılarla ifade etmek içindir. Örneğin, hidrojen iyon derişimi 1 x 10-5 mol/lt olan bir çözeltinin pH değeri 5' dir.
Oda sıcaklığında saf suyun hidrojen iyonu [H+] derişimi 1 x 10-7 mol / lt dir. Bundan dolayı saf suyun pH değeri 7 dir. Saf suda [H+ ] = [OH- ] = 10-7 mol / lt dir.
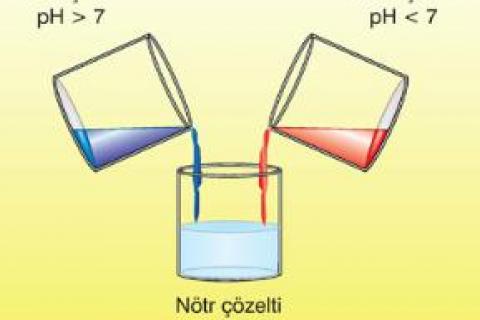
Bir çözeltinin pH değeri 0-7 arasında ise çözelti asidik Bir çözeltinin pH değeri 7-14 arasında ise çözelti bazik Bir çözeltinin pH değeri 7 ise çözelti nötürdür.
0 1 2 3 4 5 6 7 8 9 1 0 1 1 1 2 1 3
artan asitlik artan baziklik pH Skalası.
[H+ [OH- ]
pH
Çizelge 11.3. Hidrojen ve Hidroksit İyonlarının pH Skalası ve Bunlara Karşılık Gelen Derişimler.
H+ (mol / lt) pH [OH- ] (mol / lt)
10 0 = 1 0 10 -14
10 -1 = 0.1 1 10 -13
10 -2 = 0.01 2 10 -12
Asidik 10 -3 = 0.001 3 10 -11
10 -4 = 0.0001 4 10 -10
10 -5 = 0.00001 5 10 -9
10 -6 = 0.000001 6 10 -8
Nötral 10 -7 = 0.0000001 7 10 -7
10 -8 = 0.00000001 8 10 -6
10 -9 = 0.000000001 9 10 -5
10 -10 = 0.0000000001 10 10 -4
Bazik 10 -11 = 0.00000000001 11 10 -3
10 -12 = 0.000000000001 12 10 -2
10 -13 = 0.0000000000001 13 10 -1
10 -14 = 0.00000000000001 14 10 0 = 1
Çözelti pH
Hidroklorik asit (0,1 M) ............................................... 1
Mide suyu .................................................................. 1.0 - 3.0
Sitrik asit (limon suyu) ................................................ 2.2
Asetik asit (Sirke) ....................................................... 2.9
Karbonik asit (Gazoz) ................................................. 3.8
Domates suyu ............................................................ 4.2
Kahve ......................................................................... 5.0
İdrar ........................................................................... 6.0
Yağmur suyu .............................................................. 6.2
Süt ............................................................................. 6.5
Saf su ......................................................................... 7.0
Tükürük ...................................................................... 7.2
Kan ............................................................................ 7.4
Magnezyum hidroksit (Ülser ilacı) ............................. 10.5
Çizelge 11.4. Günlük Hayatımızdaki Bazı Maddelerin pH Değerleri.
5.2. pH Değerinin Ölçülmesi Bir çözeltinin pH değeri biyolojik moleküllerin aktivitesini etkilediğinden dolayı laboratuarlarda pH değerinin ölçümü büyük önem kazanır. Örneğin, bakteriler ancak dar bir pH aralığında çok iyi büyürler. Bundan dolayı, kültürün pH 'sı çok dikkatli şekilde ayarlanmalıdır.
Biyolojik katalizör olan enzimler, en iyi şekilde pH 1 - pH 4 aralığında çalışırlar. Midede bulunan pepsin enzimi için bu değer 8-9 dur.
Laboratuarlarda bir çözeltinin pH değeri pH metre denilen aygıtlar veya kolorimetrik indikatörler ile yapılır. Kolorimetrik yöntemde, asit-baz indikatörleri denilen belli hidrojen iyon derişimleriyle renkleri değişen kimyasal boyalar kullanılır (Çizelge 11.5) Örneğin, nitrazin boyası içeren kağıt pH 4,5 de sarı, pH 7,5 de mavidir. Bu tür özel kağıtlar hastanelerde idrarın pH'sını ölçmede çok kullanılır. Asidik idrar, kağıdı sarıya çevirerek ortada ciddi bir rahatsızlığın olduğunu gösterir.
metil oranj indikatörü pH'nin dörtten yüksek olduğu çözeltilerde sarı, düşük olduğu çözeltilerde ise kırmızıdır. Benzer şekilde fenol ftalein indikatörü pH 'nin 8 'den düşük olduğu çözeltilerde renksiz, pH 'nin 10 'dan yüksek olduğu çözeltilerde kırmızıdır.
Tuzlar
Tuz kristalleriTuz, kimyada, bir asitle bir bazın tepkimeye girmesi neticesinde meydana gelen madde. Tuz bazdaki artı yüklü iyonla asitteki eksi yüklü iyondan meydana gelir. Asitle baz arasındaki tepkime nötrleşme tepkimesi olup bu esnada tuz ve su ortaya çıkar. Erimiş tuz veya çözelti halindeki tuzların çoğu eksi ile artı yüklü iyonlarına ayrışır ve elektriği iletir. Tuz adı ayrıca sofra tuzu veya sodyum klorür (NaCl) için de kullanılır.
Tuz çeşitleri [değiştir]Tuzları çeşitli şekilde sınıflandırmak mümkündür. Sınıflandırmanın birisi tuzun bünyesinde OH- veya H+ iyonunun olup olmayışına bağlı olandır. Bu sınıflandırmada tuzlar normal, asidik ve bazik tuzlar şeklinde sınıflandırılır. Normal tuz; tam nötralleşme ürünü olup, meydana getirici asit ve baz kuvvet olarak birbirine denktir. NaCl, NH4Cl, Na2SO4, Na2CO3, Na3PO4 ve Ca3(PO4)2 birer normal tuzdur.
Asidik tuzlar [değiştir]Asidik tuzlar, tuzun bünyesinde bir veya daha çok proton vardır. Suda çözündükleri zaman bünyelerindeki protonu vererek ortamı asidik yapar. NaH CO3, COO-, Na2H PO4 ve NaHSO4 birer asidik tuzdur.
Bazik tuzlar [değiştir]Bazik tuzlar, bünyelerinde en az bir OH iyonu bulunduran tuzlardır. Suda çözündükleri zaman ortamı bazik yaparlar. Pb(OH)Cl, Sn(OH)Cl ve Al(OH)2Cl'de olduğu gibi. Diğer sınıflandırma metodunda ise, basit, çift ve kompleks tuzlar şeklinde sınıflandırılır. NaCl, NaHCO3 ve Pb (OH)Cl gibi tuzlar basit tuzlardır.
Çift tuzlar [değiştir]Çift tuzlar iki basit tuzdan meydana gelen tuzlardır. Bunlar suda çözündükleri zaman kendilerini meydana getiren iyonlara ayrışır. Şaplar da çift tuzlar sınıfına girer. Na Al(SO4)2 ve NH4Cr(SO4)2 birer çift tuzdur. Kompleks tuzlar, asit kökü aynı olan iki basit tuzun kompleks kök vererek meydana getirdiği tuzlardır.
K4Fe(CN)6, K3Fe(CN)6, birer kompleks tuzdur. Bunlar suda çözündükleri zaman kendini meydana getiren tuzların iyonlarına ayrışmazlar.
Tuzlar, önce metalin ismi, sonra asidin kökü söylenerek adlandırılır. Na2SO4 = sodyum sülfat, KCl= potasyum klorür, KHCO3 = potasyum hidrojen karbonat (potasyum bikarbonat) gibi.
Bazı tuzlar, kuvvetli asit ve zayıf bazdan veya kuvvetli baz ve zayıf asitten meydana gelmiştir. Bu tuzlar suda çözündükleri zaman hidrolize uğrarlar ve çözeltiyi asidik veya bazik yaparlar.
Tuzların elde edilişi:
Asit ve bazların nötralleşmesinden elde edilirler:
Baz + Asit → Tuz + Su
Metallere asit tesir ettirmekle elde edilirler:
Metal + Asit → Tuz + H2
Alıntı: http://www.dersdoktoru.com/default.asp?sayfala=dersnotugoster&id=133&der...