Sınıf:
Ünite:
Periyodik Tablonun Tarihçesi
Elementler arası ilişkileri görebilmek, maddelerin yapısını ve özelliklerini anlayabilmek için elementlerin sınıflandırılması önemlidir. 19. yüzyılda yaşayan bilim insanlarının çalışmaları sonucunda elementlerin benzer fiziksel ve kimyasal özelliklerine göre sınıflandırılması için kullanılan periyodik tablo (periyodik cetvel / periyodik sistem) ortaya çıkmıştır.
PERİYODİK SİSTEMİN TARİHÇESİ TARİH ŞERİDİ İÇİN TIKLAYINIZ
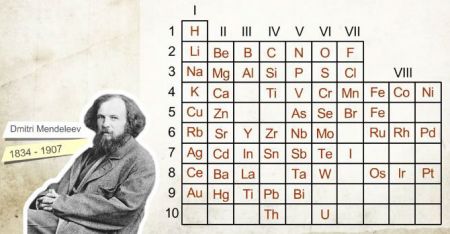
1869 yılında Mendeleyev, elementleri atom ağırlıklarına göre yan yana dizmiş, benzer özellikte elementler çıktığında yeni bir satıra geçmiştir. Bu şekilde Mendeleyev bugün kullandığımız periyodik tablonun temellerini atmıştır.
Julius Lothar Meyer, yaptığı çalışmalarda Mendeleyev’le aynı sonuçlara varmış fakat çalışmaları Mendeleyev’den daha sonra yayımlandığı için Mendeleyev bu konuda daha bilinen bir isim olmuştur.
1913 yılında Henry Moseley’in X-ışınları ile elementler üzerinde yaptığı çalışmalar sonucunda, periyodik tabloda elementleri atom ağırlıklarına göre değil atom numaralarına yani proton sayılarına göre sıralamıştır.
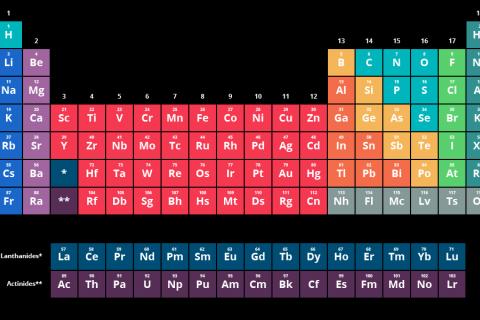
Periyodik Tablonun Genel Yapısı
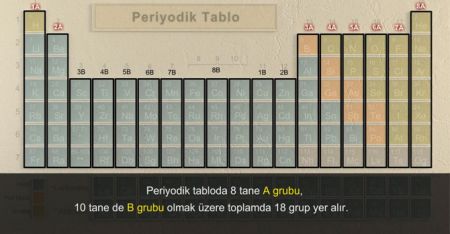
- Periyodik tablodaki yatay sıralar periyot, dikey sıralar ise grup olarak adlandırılır. Aynı grupta olan yani periyodik tabloda alt alta yer alan elementlerin kimyasal özellikleri benzerlik gösterir.
- Periyodik tabloda sekiz tanesi A grubu, on tanesi B grubu olmak üzere toplam on sekiz grup, yedi tane de periyot bulunur. Dördüncü periyottan itibaren 2A ve 3A grupları arasında B grupları bulunur.
Periyodik Tablo ve Elektron Katman Dizilimi
Elementlerin elektron katman dizilimleri yapıldığında değerlik elektron sayısı periyodik tablodaki grup numarasını, toplam enerji katmanı ise periyot sayısını verir. Aynı periyotta bulunan elementlerin elektron katman sayıları aynıdır. Aynı grupta bulunan elementlerin de değerlik elektron sayıları aynıdır.
Helyum’un değerlik elektron sayısı 2 olmasına rağmen ilk enerji katmanının alabileceği en fazla elektron sayısına sahip olduğu için soygaz özellikleri sergiler bu sebeple 8A grubunda bulunur.
Elementlerin Sınıflandırılması
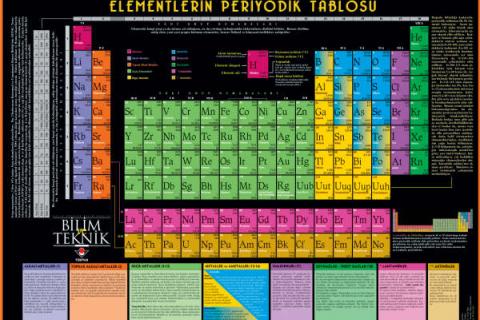
Elementler; metal, ametal ve yarı metal olarak üç gruba ayrılır.
Metal, Ametal ve Yarı Metallerin Fiziksel Özellikleri
Metaller;
- Isı ve elektriği iyi iletir.
- Oda sıcaklığında katı hâlde bulunur.
- Esnek oldukları için, tel ve levha hâline getirilebilir.
- Yüzeyleri parlaktır.
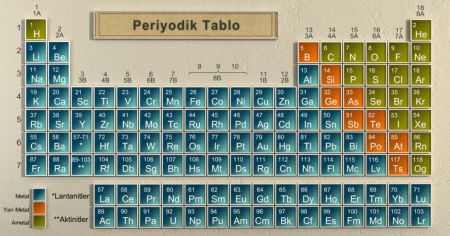
Periyodik tabloda metaller sol ve orta kısımda yer alır. En solda alkali metaller olarak adlandırılan 1A grubu, 1A grubunun yanında toprak alkali metaller olarak adlandırılan 2A grubu yer alır.
Ametaller;
- Isı ve elektriği iyi iletmez.
- Oda sıcaklığında katı, sıvı ya da gaz hâlinde bulunur.
- Kırılgan oldukları için, tel ve levha hâline getirilemez.
- Saydam ya da ışık geçirmez olabilir.
Periyodik tabloda, ametaller genellikle sağ tarafta yer alır. Hidrojen ise periyodik tablonun sol üst köşesinde yer almaktadır. Periyodik tablonun en sağında soygazlar olarak adlandırılan 8A grubu, soygazların hemen solunda halojenler olarak adlandırılan 7A grubu bulunmaktadır.
Yarı metaller;
- Isı ve elektriği iletir.
- Oda sıcaklığında katı hâlde bulunur.
- Tel ve levha hâline getirilebilmeleri metaller kadar kolay değildir, elementin özelliğine göre değişiklik gösterebilir.
- Bazı yarı metaller parlak, bazısı mat yüzeye sahiptir.
İstisnalar:
- Cıva (Hg), oda sıcaklığında sıvı hâlde bulunan bir metaldir.
- Grafit, karbondan (C) oluşan, ısı ve elektriği iyi ileten bir ametaldir.
- Brom (Br), oda sıcaklığında sıvı hâlde bulunan bir ametaldir.
Metal, Ametal ve Yarı Metallerin Kullanım Alanları
Metaller, dayanıklı oldukları, ısı ve elektriği iyi ilettikleri için bina yapımından, televizyon, cep telefonu gibi elektronik aletlere kadar birçok alanda kullanılmaktadır. Parlak yüzeye sahip olmaları nedeniyle takı yapımında kullanılmaktadır.


Ametaller ısıyı ve elektriği iyi iletmedikleri için yalıtım malzemesi olarak kullanılabilir. Ayrıca endüstriyel ürünler, deterjanlar ve neon lambalar gibi geniş bir kullanım alanına sahiptir. Kullandığımız kurşun kalem uçları da karbon elementinden elde edilen grafitten üretilir.


Yarı metaller, hem metaller hem de ametallere benzer özellikler göstermektedir. İletken oldukları için, bilgisayarlarda kullanılan dijital parçaların yapımında kullanılır.

KONUYLA İLGİLİ VİDEO:
Kaynak: EBA